医疗器械生物学评价技术要求
时间: 2021年09月28日 15:52 | 作者:朗依制药 | 来源: 医药资讯| 阅读: 169次
- 2021-09-28 15:05:41 可持续发展论坛2021丨王辰:加大医疗卫生投入
- 2021-09-28 11:17:49 AI赋能药物研发,结构生物学家们即将失业?
- 2021-09-27 19:05:23 业绩负增长、浆站数量行业最少 卫光生物要做生
- 2021-09-26 18:31:02 合肥市切实提高困难群众医疗保障待遇
- 2021-09-26 16:06:48 医保加商保,人生更美好 威海人自己的普惠医疗
- 2021-09-26 16:06:48 280块钱的农村医疗保险是交还是不交?网上便捷
- 2021-09-26 16:06:23 2021辽宁医疗卫生考试中药学:散剂
- 2021-09-25 22:48:34 中国生物制药(01177):抗肿瘤药“盐酸安罗替尼胶
- 2021-09-24 21:34:15 我国干细胞医疗市场20.57亿美元,南华生物已布局
- 2021-09-24 21:16:44 亚虹医药任命陈峪博士为新药发现部生物学研究
医疗器械生物学评价的意义
医疗器械生物相容性的主要内容
根据国际标准化组织(International Standards Organization,ISO)会议的解释,
医疗器械生物学评价的意义

医疗器械生物相容性评价的重要性
与人体接触或植入体内的医疗器械其风险性较大,百度,需 要进行生物学评价。医疗器械与人体接触或植入体内后对 宿主人体的影响是一个非常复杂的过程,主要发生三种反应:

生物学反应导致的临床结果
皮内刺激 — 局部组织发生炎症反应,皮下部位红肿、疼痛、瘙痒、水泡、溃烂及色素沉积等
遗传毒性 — 在致突变物作用下,生物体的染色体数目及结构 变化,可能引起某种遗传病症或健康缺陷。
生殖毒性 — 某些物质对雌性和雄性生殖系统,从生殖细胞 形成到胚胎细胞发育各过程所致的损害,影响繁殖能力,甚 至累及后代。
血栓栓塞 — 导致血管腔闭塞,形成心梗、脑梗、肺动脉栓塞等疾病。
肿瘤 — 长期植入后的慢性炎症反应存在引发肿瘤的风险
医疗器械生物学评价相关规章及标准
国家食品药品监督管理总局 2021年第43号《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》
《医疗器械生物学评价和审查指南》(国食药监械[2007]345号)

医疗器械生物学评价标准的目的

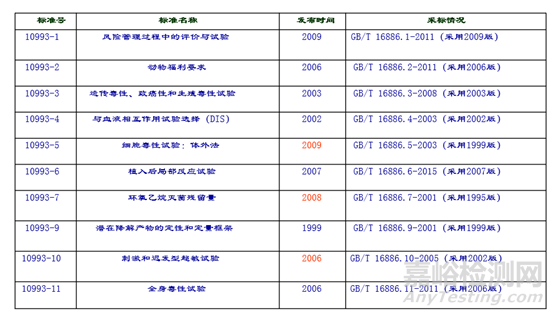
ISO 10993与GB/T 16886系列标准对应情况

医疗器械生物学评价研究资料
1.生物相容性评价的依据和方法
预期用于人体的任何材料或器械的选择和 评价应按YY/T 0316《医疗器械 风险管理 对医疗器械的应用》(ISO14971)开展风 险管理过程中的生物学评价。(见GB/T 16886.1:2021附录B)。医疗器械生物学评价程序应当按GB/T 16886.1-ISO 10993.1给出的评价流程图 开展。由于医疗器械的多样性和特殊性, 各医疗器械在按流程图进行生物学评价时, 实际产品在流程图中所走的路线是不一致的,应当对所走的路线予以详细说明。
作为风险管理组成部分的医疗器械生物学评价的系统方法框图

2.产品所用材料的描述及与人体接触的性质
产品各部件使用材料的标准化学名称。
产品预期与人体的接触分类,包括表面器械、外
部接入器械、植入器械。
产品与人体接触的组织类型,包括接触的组织类 型(损伤表面、循环血液、肌肉、骨、皮下、粘 膜等)
接触频次(频繁更换)。
产品预期与人体接触的最长时间(短期、长期、 持久)。
3.实施或豁免生物学试验的理由和论证
相关文章推荐:
- 最新文章
-
- 吃猪蹄原来真的可以丰胸,保养胸部还有这些方
- 续写乳腺“健康谱”,泰安市妇幼保健院乳腺科
- 二十四节气之夏至养生篇
- 2022济宁医学院接收推免生章程
- 2022济宁医学院接收推免生章程
- 2022济宁医学院接收推免生章程
- 2022济宁医学院接收推免生章程
- 2022济宁医学院接收推免生章程
- 博湖县博湖镇宝浪社区开展“世界急救日” 培训
- 走好新时代西藏教育新的赶考之路
- 走好新时代西藏教育新的赶考之路
- 走好新时代西藏教育新的赶考之路
- 走好新时代西藏教育新的赶考之路
- 永安社区开展世界急救日宣传活动
- 永安社区开展世界急救日宣传活动
- 中国航油迅速应对泸县地震 全力保障供油安全
- 亚洲龙故障频发 一汽丰田“致真至极”品质光环
- 金鹰股份(600232)股票股价,行情,新闻,财报数据
- 金鹰股份(600232)股票股价,行情,新闻,财报数据
- 广东东阳光科技控股股份有限公司关于上海证券
- 热门文章
-
- 2035年)》印发:进一步完善中医药知识产权综合保
- 中医药知识产权保护工作座谈会在我市召开弘扬
- 传统中药材市场格局在变迁
- 2021税务师税法一模拟题:零售和进口罕见病药品
- 紫云多渠道宣传禁毒知识
- 这些药便宜又好用,为什么药店买不到?
- 管清友:廉价药品目录制度建设需多方政策配合
- 有人问艾灸在家里做好还是在艾灸馆做好?
- 集中整治!新密开展艾灸馆违法违规专项检查!
- 泸州艾灸馆加盟代理
- 9月1日起,海南将中药饮片等纳入门诊慢性特殊疾
- 合理用药宣传‘全心守护’百城行活动”启动
- 信谁好?宁波一女子买药:同样的药,两家药房
- 焕新归来,新康泰克与零售药店“同呼吸共命运
- 为什么广州的一个中药市场,成了外国游客的打
- 网售“三伏贴”乱象调查:真假难辨、分类混乱
- 人民日报:整治“饭圈”乱象 清朗网络空间
- 截至今年6月 中国网上外卖用户规模已达4.69亿
- 男子火场徒手爬楼救女童 外孙女眼中他是“蜘蛛
- 对话开立医疗董事长陈志强:变革进行时
- 友情链接: